Единица измерения жесткости воды — Понимание понятия ‘Жёсткость воды’
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Жёсткая и мягкая вода
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п.
Следует отметить, что избыточное использование слишком мягкой воды может способствовать коррозии труб. Это обусловлено отсутствием кислотно-щелочного баланса, который поддерживается за счет гидрокарбонатной (временной) жесткости.
При необходимости, могу рассказать об единице измерения жесткости воды и её значении.
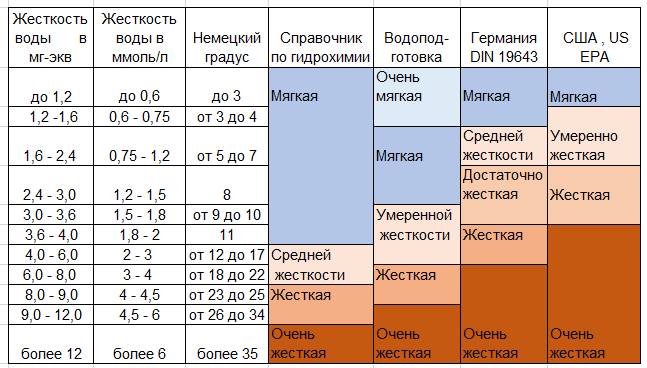
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. В России для измерения жёсткости иногда использовалась нормальная концентрация ионов кальция и магния, выраженная в миллиграммах эквивалента на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
С 1 января 2005 года в России введен новый Национальный стандарт Российской Федерации ГОСТ Р 52029-2003 «Вода. Единица жесткости»[1]. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1 °Ж = 1 мг-экв/л).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина |
|---|---|---|---|
| °Ж | ммоль/л | ||
| Немецкий | °dH (degrees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) |
1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | |
| Американский | ppm | 1 часть CaCO3 на 1 000 000 частей воды |
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 °Ж, в мае — 0,5 °Ж [2]). В подземных водах жёсткость обычно выше (до 80-100 °Ж) и меньше изменяется в течение года.
Методы устранения
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:

- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
См. также
- Кислые соли
- Щелочи
- Сульфаты
- Хлораты
Ссылки
- Единицы концентрации
- Градусы жёсткости воды
- Пересчет градусов жесткости воды
Примечания
- ↑ Национальный стандарт Российской Федерации ГОСТ Р 52029-2003 «Вода. Единица жесткости».
- ↑ Химическая энциклопедия. — М.: Советская энциклопедия, 1990. Т. 2. С. 145.
В чем измеряется жесткость балки?
Жесткость балки — это ее способность сопротивляться изгибу под действием внешних нагрузок. Жесткость измеряется в единицах, называемых Н/м² или Па (паскаль), которые представляют собой единицы измерения давления. Жесткость балки также может быть выражена в кН/м² (килоньютон на квадратный метр) или в psi (фунтах на квадратный дюйм), в зависимости от системы измерения. Жесткость балки обычно определяется экспериментально с помощью тестов на изгиб, которые позволяют определить отношение между приложенной нагрузкой и деформацией балки.

